
公(gōng)司新(xīn)闻
【首家】立新(xīn)制药盐酸尼洛替尼原料药國(guó)内获批转“A”
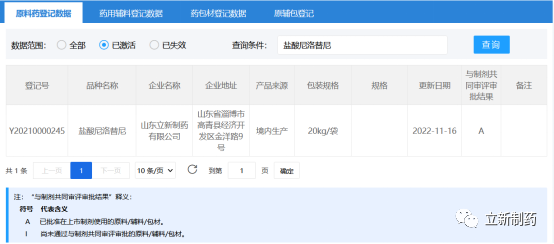
据11月16日國(guó)家药品监督管理(lǐ)局官网显示,山(shān)东立新(xīn)制药有(yǒu)限公(gōng)司的盐酸尼洛替尼原料药[登记号:Y20210000245]已通过药品审评中(zhōng)心(CDE)技(jì )术审评,成為(wèi)國(guó)内首家在CDE原辅包登记平台获批转A的企业,也是该原料药在全球范围内的首仿获得CDE官方认可(kě)。
盐酸尼洛替尼是一种具(jù)有(yǒu)高度选择性的络氨酸激酶抑制类抗肿瘤药物(wù),用(yòng)于有(yǒu)效治疗产(chǎn)生耐药的或不耐受的慢性髓性白血病患者。
盐酸尼洛替尼合成工(gōng)艺复杂、质(zhì)量要求高。立新(xīn)制药研发团队集中(zhōng)优势资源,一路攻坚克难,成功突破多(duō)项技(jì )术壁垒,在绿色工(gōng)艺、杂质(zhì)研究以及晶型粒径等诸多(duō)方面形成了具(jù)有(yǒu)鲜明特色和竞争优势的技(jì )术成果。本次“首仿”必将成為(wèi)公(gōng)司发展史上的重要里程碑。
此外,立新(xīn)制药广泛布局全球市场盐酸尼洛替尼原料药产(chǎn)品。目前,苏州立新(xīn)制药有(yǒu)限公(gōng)司在美國(guó)FDA注册的盐酸尼洛替尼已通过DMF技(jì )术审评,足以支持制剂ANDA上市。同时,苏州立新(xīn)和山(shān)东立新(xīn)分(fēn)别在加拿(ná)大和欧盟EDQM进行了登记注册,均已进入审评审批阶段,不久也将获批上市。
立新(xīn)制药始终坚持执行全球规范,加强國(guó)际合作(zuò)、國(guó)际注册、國(guó)际认证,多(duō)次通过FDA、EDQM、EMA和PMDA等权威机构的认证。公(gōng)司将持续加大國(guó)际认证和注册力度,发挥國(guó)际化优势,拓展國(guó)际市场。
相关新(xīn)闻
2024.04.26
2024.02.21
2023.07.24
2023.07.10
2023.03.21